Näidustus (heakskiidetud kasutamine): 2019. aastal kiitis FDA selle heaks omandatud, generaliseerunud hüpoaktiivse suguelundi häire (HSDD) raviks premenopausis naistel, kui seisund põhjustab märkimisväärset stressi ja ei ole tingitud muudest meditsiinilistest/psühhiaatrilistest seisunditest ega ravimite kõrvaltoimetest.
Toimemehhanism
PT-141 on melanokortiini retseptori agonist (peamiselt MC4 retseptor), mis moduleerib seksuaalset iha kesknärvisüsteemi radade kaudu.
Erinevalt PDE5 inhibiitoritest (nt sildenafiil), mis mõjutavad peamiselt veresooni, toimib PT-141 tsentraalselt, mõjutades seksuaalset motivatsiooni ja erutust.
Farmakoloogia ja annustamine
Manustamine: Vajadusel subkutaanne süst.
Heakskiidetud annus: 1,75 mg subkutaanselt
Farmakokineetika:
Tmax ≈ ~60 minutit
t½ ≈ 2–3 tundi
Mõju võib kesta mitu tundi, mõnedes aruannetes kuni ~16 tundi.
Kliiniline efektiivsus (III faasi uuringud – RECONNECT, 24 nädalat, randomiseeritud kontrollitud uuringud)
Esmased tulemusnäitajad:
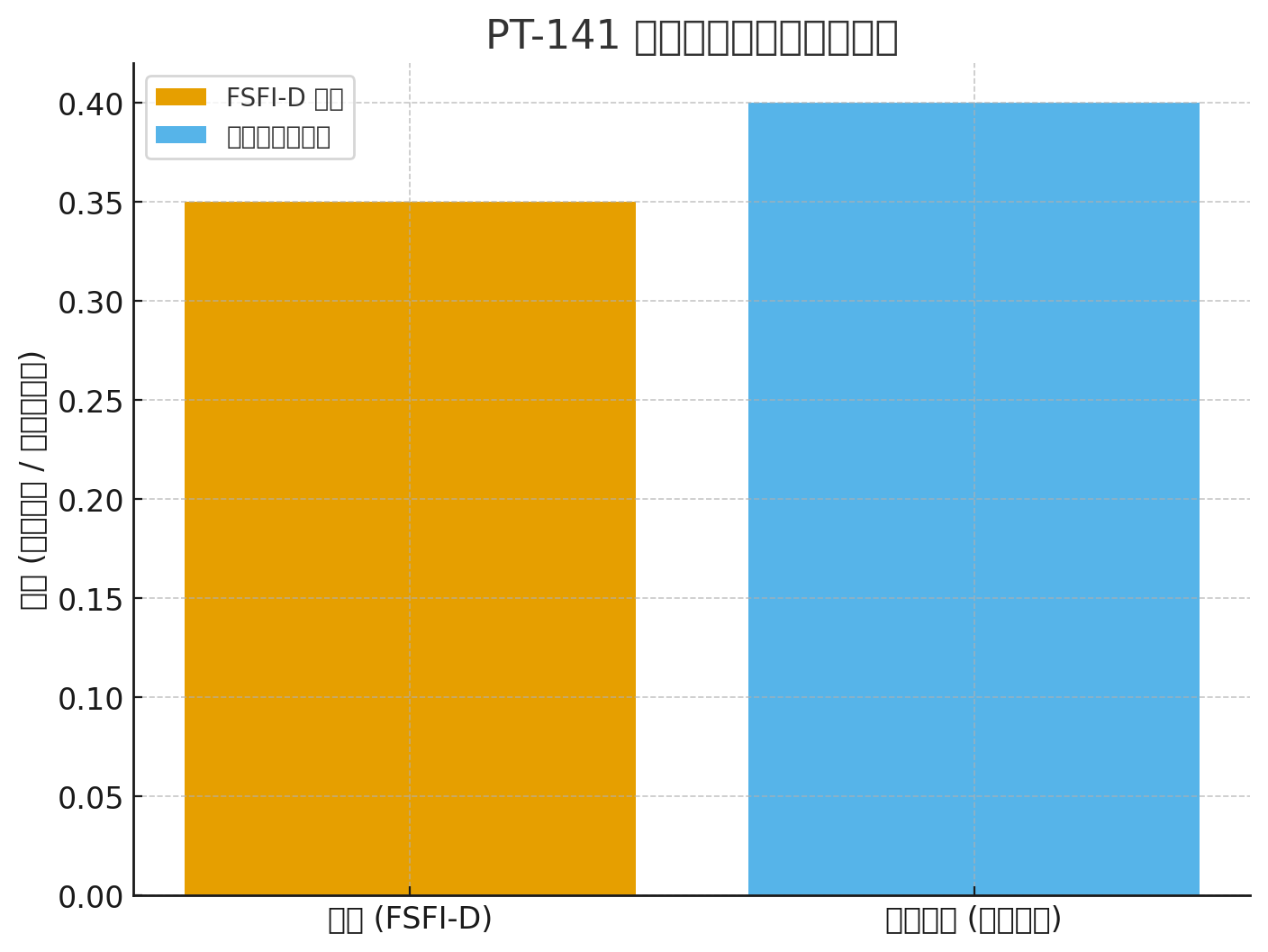
Naiste seksuaalfunktsiooni indeks – soovi domeen (FSFI-D)
Naiste seksuaalse stressi skaala (FSDS-DAO)
Peamised tulemused (uuringute 301 ja 302 koondandmed):
FSFI-D paranemine: +0,35 vs platseebo (P<0,001)
FSDS-DAO skoori vähenemine: −0,33 vs platseebo (P<0,001)
Muud tulemusnäitajad: Toetavad tulemused (seksuaalfunktsiooni skoorid, patsiendi enda hinnangul rahulolu) olid positiivse trendiga, kuid rahuldavate seksuaalsündmuste (SSE-de) osas ei täheldatud alati järjepidevaid olulisi erinevusi.
Kõrvaltoimed (kõige sagedamini uuringutes teatatud)
Sage (≥10%):
Iiveldus (~30–40%; uuringutes teatatud kuni ~40%)
Punetus (≥10%)
Peavalu (≥10%)
Kardiovaskulaarsed toimed:
Täheldati mööduvat vererõhu tõusu ja südame löögisageduse muutusi, mis tavaliselt taandusid mõne tunni jooksul.
Vastunäidustatud või ettevaatusega manustatakse patsientidele, kellel on kontrollimatu hüpertensioon või südame-veresoonkonna haigused.
Maks: Harvadel juhtudel on teatatud mööduvast maksaensüümide aktiivsuse tõusust; äärmiselt harvad juhtumid viitavad võimalikule ägedale maksakahjustusele, kuid mitte sagedane.
Pikaajaline ohutus (laiendusuuring)
52-nädalases avatud jätku-uuringus leiti püsivat iha paranemist ilma uute oluliste ohutussignaalideta.
Pikaajalist ohutusprofiili peetakse üldiselt hästi talutavaks, kusjuures peamised talutavusprobleemid on endiselt lühiajalised kõrvaltoimed, näiteks iiveldus.
Peamised kasutusmärkused
Heakskiidetud populatsioon on piiratud: Ainult premenopausis naistele, kellel on omandatud, generaliseerunud HSDD.
Meestele laialdaselt mitte heaks kiidetud (erektsioonihäired ehk meeste madal soov on endiselt uurimise all).
Ohutuskontroll on kriitilise tähtsusega: enne ravimi väljakirjutamist tuleb hinnata hüpertensiooni, südame-veresoonkonna haiguste ja maksafunktsiooni anamneesi olemasolu.
Kiire andmete kokkuvõte
FDA heakskiit: 2019 (Vyleesi).
Annus: 1,75 mg subkutaanse süstina vastavalt vajadusele.
Farmakokineetika: Tmax ~60 min; t½ 2–3 h; toime kuni ~16 h.
Efektiivsus (III faas, koondatud):
FSFI-D: +0,35 (P<0,001)
FSDS-DAO: −0,33 (P<0,001)
Kõrvaltoimed:
Iiveldus: kuni ~40%
Punetus: ≥10%
Peavalu: ≥10%
Täheldatud on mööduvat vererõhu tõusu.
Võrdlustabel ja graafik (kokkuvõte)
| Uuring / andmetüüp | Lõpp-punkt / Mõõt | Väärtus / kirjeldus |
|---|---|---|
| III faas (301+302 koondatud) | FSFI-D (soovide domeen) | +0,35 vs platseebo (P<0,001); FSDS-DAO −0,33 |
| Kõrvaltoimed | Iiveldus, punetus, peavalu | Iiveldus ~30–40% (maksimaalselt ~40%); punetus ≥10%; peavalu ≥10% |
Postituse aeg: 30. september 2025